Opciones de cultivos de cobertura para zonas cálidas y húmedas
Por Justin Duncan, especialista en agricultura de NCAT
Foto: Investigación en Agricultura Ecológica Subtropical (SOAR)
Resumen
Los cultivos de cobertura pueden adaptarse mejor a algunas regiones que a otras. En esta publicación se analizan las características de los cultivos de cobertura más adecuados para las zonas con veranos cálidos y húmedos, como las partes meridionales de Texas y Florida y a lo largo de la costa del Golfo, el Caribe, Hawai y otros puntos con condiciones climáticas similares. Incluye una tabla que le permitirá tomar la mejor decisión para su situación sobre qué cultivos de cobertura pueden adaptarse a sus necesidades individuales. También incluye una guía general de inoculantes para los cultivos de legumbres.
Contenido
Introducción
Opciones de cultivos de cobertura subtropicales
Referencias
Más recursos
Apéndice 1: Grupos de inoculantes
Introducción
Uno de los retos de la producción de cultivos ecológicos en lugares cálidos y húmedos es la selección y gestión adecuada de los cultivos de cobertura. ¿Qué cubiertas son las más adecuadas? ¿Qué puede soportar el calor? Demasiadas veces las respuestas disponibles no son adecuadas para las zonas más cálidas y húmedas. Esta publicación explorará algunas opciones para las zonas de rusticidad del USDA 8 y superiores. Puede encontrar un mapa interactivo de las zonas de rusticidad de las plantas aquí.
El cultivo de cobertura es especialmente importante en lugares cálidos porque la materia orgánica del suelo se volatiliza más rápidamente en las zonas más cálidas que en las más frías. Las zonas más frías tienen más materia orgánica, pero son más sensibles a la pérdida de esa materia orgánica con temperaturas más altas. Por ejemplo, en una zona fría se puede esperar una pérdida del 10% de la materia orgánica, pero en una región más cálida sólo un 3%, si la temperatura media aumenta 1° Celsius. Lo que esto sugiere es una estratificación de la resistencia de la materia orgánica del suelo. Consideremos, por ejemplo, los materiales leñosos: tardan más en descomponerse que las hojas. Así, a medida que la materia orgánica se deposita en el suelo, los materiales más resistentes son los últimos en descomponerse, mientras que los demás materiales -en orden descendente de dureza- se descomponen a un ritmo acelerado en relación directa con el aumento de la temperatura ambiente del suelo. Así, en los suelos más calientes hay menos materia orgánica, pero no son tan sensibles a los aumentos de temperatura como los suelos más fríos. Esto es muy importante porque, a medida que los suelos de las regiones más frías pierden materia orgánica, también pierden la capacidad de retener agua, lo que contribuye a calentar las temperaturas ambientales (Kirschbaum, 1995).
Dado que la descomposición en los suelos cálidos y húmedos es tan rápida, se necesita aproximadamente el doble de aportación de materia orgánica al suelo para reemplazar la materia orgánica que se pierde por volatilización y cosecha de los cultivos. Así, un productor de una zona cálida y húmeda está librando tres batallas con la materia orgánica del suelo, y todas son cuesta arriba. En primer lugar, el calor, que agota la materia orgánica del suelo. La siguiente es la gran cantidad de material que se necesita para devolver la fertilidad al suelo en cada temporada o ciclo de cultivo, y la tercera es mantener la suficiente humedad del suelo para retener la limitada materia orgánica que hay. En los sistemas de siembra directa, se pierde aproximadamente la mitad de la materia orgánica del suelo por descomposición que en la labranza convencional (Vieira et al., 2009).
La materia orgánica del suelo también regula la descomposición del nitrógeno y el carbono disponibles y los conserva de forma relativa: es decir, cuanta más materia orgánica tenga el suelo, más carbono y nitrógeno podrá retener, lo que aumenta la actividad microbiana del suelo. Otro efecto de una mayor materia orgánica del suelo es que dispersa los minerales que pueden tener efectos negativos, como el hierro, al unirse a ellos en la matriz de materia orgánica del suelo (Bayer et al., 2000). Este y otros metales pueden ser tóxicos en concentraciones elevadas en el suelo e inhibir el crecimiento de las raíces. En los suelos ácidos con niveles tóxicos de manganeso, las moléculas orgánicas como la cisteína y los ácidos tánicos, que se encuentran fácilmente en los materiales vegetales, pueden ser útiles para reducir las cantidades a niveles menos perjudiciales (Hue et al., 1999). También se ha descubierto que otro metal altamente tóxico que se encuentra en los suelos ácidos, el aluminio, es relativamente “desarmado” por los ácidos orgánicos que se encuentran en el suelo. Estas fijan suficiente aluminio para influir en el crecimiento de las raíces de forma significativa (Hue et al., 1985).
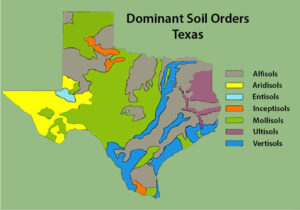
Figura 1. Las bandas de órdenes del suelo en la parte oriental del estado son representativas de la deposición del suelo durante los cambios en el nivel del mar. La parte occidental del estado, de mayor altitud, no presenta el efecto de banda. Mapa utilizado con permiso del USDA NRCS.
Aunque la materia orgánica del suelo (SOM) es muy importante para la salud del suelo (Gosper y Murray, 2003), es más difícil de mantener en las zonas más cálidas. Las opciones para construir SOM son variadas. Los productores pueden añadir compost o estiércol, utilizar la siembra directa o incorporar cultivos de cobertura en la rotación y posteriormente en el suelo. Los cultivos de cobertura suelen utilizar cultivos no monetarios para cubrir el suelo con el fin de evitar la erosión y la acumulación de malas hierbas y generar y regular la materia orgánica del suelo. La mayor parte de la literatura en Estados Unidos sobre cultivos de cobertura se refiere a regiones más templadas, por lo que la información sobre coberturas para zonas más cálidas, como el Valle del Río Grande en el sur de Texas, es escasa. Este entorno es más subtropical que templado, más parecido al sur de Florida o al sur de California. Las heladas rara vez molestan a estas zonas, por lo que los cultivos de cobertura que funcionan bien en otras zonas, como la veza y los guisantes austriacos, pueden no hacerlo tan bien (Jeuffroy et al., 1990). En cambio, los cultivos de cobertura más tropicales pueden ser útiles en estas zonas porque ofrecen temporadas de crecimiento más largas y proporcionan más unidades de calor que las disponibles en regiones más templadas.
Una de las consideraciones a la hora de elegir un cultivo de cobertura es su comportamiento en el suelo. Debe tener en cuenta que, aunque un cultivo de cobertura se comporte generalmente bien en su región, su tipo de suelo específico puede ser muy diferente de las condiciones ideales de la cobertura. Esto es común en lugares como Texas, donde hay bandas de tipos de suelo depositados en diferentes momentos ecológicos.
La Figura 1 ilustra que en el extremo sur del estado, el Valle del Río Grande tiene cuatro órdenes principales de suelos, con los Vertisoles separados en dos regiones principales, una a lo largo de la costa y la otra a lo largo del Río Grande y sus afluentes en el sur de Texas. Estas diferencias de suelo explican por qué algunos tipos de vegetación se encuentran en un lugar y no en otros.
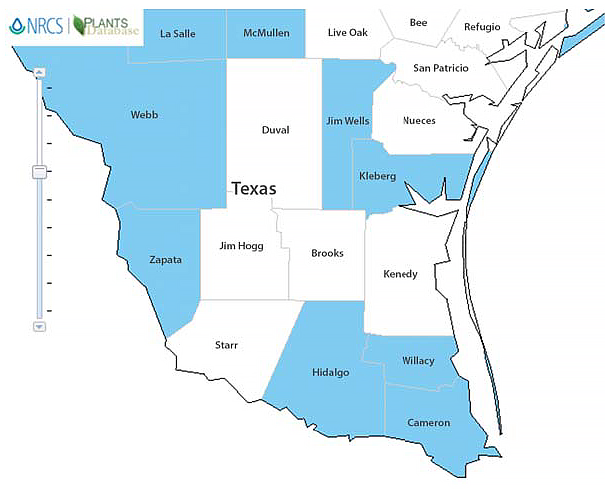
Figura 2. Distribución conocida de Medicago polymorpha (trébol de tierra) en el sur de Texas. Gráfico: cortesía de USDA NRCS.
Si comparamos las figuras 1 y 2, podemos ver que, aunque los patrones climáticos son similares en toda la zona, M. polymorpha no se encuentra en todos los condados. Esto podría atribuirse a que algunos de los tipos de suelo no son propicios para el crecimiento de esa especie en particular.
El agua también es una consideración muy importante. Los patrones de lluvia y las fluctuaciones de esos patrones pueden determinar si su cultivo de cobertura tiene éxito o no. Ha habido casos en los que las lluvias previstas no cayeron después de la siembra de los campos, lo que dio lugar a una germinación irregular del cultivo de cobertura. Esto permitió que las malas hierbas se establecieran en el campo de transición, anulando el propósito del cultivo de cobertura. Una forma de prevenir esta situación es mezclar las semillas. Algunas cubiertas requieren más humedad no sólo para la germinación, sino también en la fase inicial de crecimiento. Se podría utilizar una mezcla de semillas para superar las limitaciones climáticas o de humedad durante la siembra inicial. Una vez que los cultivos de cobertura han tomado la humedad que necesitan del suelo, entonces conservan la humedad del suelo mediante el sombreado, actuando como un mantillo vivo (Salako y Tian, 2003).
Otra consideración es el uso final del cultivo de cobertura. En muchas ocasiones, los cultivos de cobertura se labran para aprovechar la liberación de sus nutrientes en el suelo y para añadir materia orgánica que mejore el suelo y su salud. Algunos productores optan por dejar el cultivo de cobertura terminado para poder utilizar los residuos como mantillo para el siguiente cultivo. La capacidad de recuperación de los residuos desempeña un papel importante en la utilidad de un determinado cultivo como cubierta, ya que algunas cubiertas son mucho más sustanciales que otras en este sentido. Los guisantes de invierno austriacos, cuando se cultivan en el húmedo sur de Estados Unidos, se descomponen muy rápidamente y son relativamente blandos. Las semillas se pueden sembrar fácilmente en los residuos de este cultivo de cobertura. Por el contrario, un cultivo como los guisantes de hierro y arcilla deja un residuo más robusto y necesita ser segado con una desbrozadora antes de poder utilizar el campo. Además, las estaciones son importantes para los cultivos de cobertura. Los guisantes de invierno austriacos son plantas anuales de estación fría en el sur húmedo. En mayo suelen haber completado su ciclo vital, dejando un campo listo para ser plantado. Los guisantes de hierro y arcilla, en cambio, son una planta anual de estación cálida que producirá abundante material vegetativo hasta que las heladas los maten. Segar antes de las heladas puede no ser suficiente para evitar que esta enredadera rebrote. Es fundamental conocer a fondo el cultivo, el suelo y la cubierta vegetal, ya que son muchos los factores que influyen en ellos en la explotación. Mantenga un registro para saber qué ha funcionado mejor y cuándo. Para más información, consulte la publicación de ATTRA Scheduling Vegetable Plantings for Continuous Harvest.
Dado que esta publicación se centra en las zonas más cálidas, los cultivos de cobertura que aquí se comentan son estrictamente para lugares con una temporada de crecimiento de al menos 9 a 10 meses. Para que estos cultivos de cobertura sean eficaces, deben ser capaces de rendir al máximo. Los peligros de plantarlas en zonas con un tiempo inadecuado para crecer es que no persisten y no completarán su ciclo de vida, ni fijarán la cantidad de nitrógeno que se espera, porque su vida fue cortada por el clima (Muir, 2012).
Muchos cultivos de cobertura son leguminosas, lo que significa que requieren un inoculante de rizobios antes de la siembra. Mientras se desarrollan las raíces jóvenes, el Rhizobium “infecta” las raíces cooperando primero con la planta para formar hilos de infección. Estos túbulos permiten que los rizobios se desplacen desde el exterior de la planta hasta la corteza de la raíz, donde la bacteria se “instala” para producir nódulos fijadores de nitrógeno. Estos rizobios son específicos del hospedador y suelen requerir un inoculante para asegurar su presencia en el suelo. En muchos casos, los rizobios formarán nódulos en una leguminosa fuera de su zona de acogida, pero los nódulos no funcionarán correctamente y en lugar de fijar el nitrógeno actuarán como una especie de enfermedad en la planta (Gage, 2004). Los nódulos funcionales son casi siempre de un tono rosado cuando se abren, mientras que los nódulos no funcionales son grises, bronceados o marrones cuando se abren. Es muy importante adquirir los rizobios adecuados para acompañar a las semillas de cobertura de leguminosas, con el fin de fomentar la simbiosis adecuada para garantizar la productividad del cultivo. En el trébol, esto puede significar un aumento de siete veces la materia seca con respecto al trébol no inoculado. Otras leguminosas muestran tendencias similares en la producción cuando van acompañadas de los rizobios adecuados (Bailey, 1915).
Cultivos de cobertura permanentes
En algunas situaciones, es beneficioso tener una plantación permanente de un cultivo de cobertura, también llamado cubierta vegetal perenne. Esto es especialmente cierto en el caso de los huertos establecidos. Las cubiertas del suelo contribuyen tanto a la salud del suelo como a la de los árboles. Sin embargo, hay un problema. Las leguminosas se crean problemas en la naturaleza debido a su hábito de fijación de nitrógeno. Las leguminosas suelen ser especies pioneras que se desenvuelven bien en terrenos alterados. Una vez que enriquecen el suelo con nitratos, los competidores herbáceos se aprovechan y usurpan el control de la zona. Para que una leguminosa se utilice como cubierta permanente, tiene que ser capaz de superar a las hierbas. Un ejemplo de cultivo de cobertura que puede hacer esto es el cacahuete perenne, del que se habla con más detalle más adelante en esta publicación.
La nodulación de Rhizobium puede verse afectada negativamente por muchos factores diferentes, lo que a su vez provoca una merma en el rendimiento. Este arrastre del rendimiento se ve agravado porque los factores que afectan a la nodulación suelen afectar también a la planta de forma negativa. Por ejemplo, la baja temperatura del suelo reduce la nodulación porque los genes que determinan la iniciación de los nódulos se inactivan al disminuir las temperaturas. La salinidad del suelo también puede afectar a las tasas de nodulación. Los efectos de la salinidad pueden diferir enormemente de una especie a otra de leguminosa y también del tipo de rizobio. Por ejemplo, los rizobios de Acacia y Prosopis, curiosamente, son sensibles a los productos químicos del suelo, y la presencia de esos productos químicos reducirá su eficiencia y eficacia para inducir la formación de nódulos (Fox et al., 2007).
Otro beneficio de los cultivos de cobertura es que pueden proporcionar un hábitat para los insectos beneficiosos, que pueden utilizar los cultivos de cobertura como un área de reunión para visitar los campos adyacentes para atacar a sus presas (Wang, 2012).
Los cultivos de cobertura también pueden ayudar a suprimir las malas hierbas dentro de una rotación de cultivos. Muchas especies de cultivos de cobertura presentan alelopatía, que es la supresión del crecimiento de una planta por otra. Esto puede ser útil para la supresión de las malas hierbas, como ocurre con el uso de ryegrass o harina de gluten de maíz para suprimir las malas hierbas, pero podría ser perjudicial si se utiliza el cultivo de cobertura equivocado, como ciertas leguminosas con el algodón. La emergencia de las plántulas de algodón se redujo hasta un 60% con la incorporación de cantidades variables de residuos de veza peluda y trébol carmesí (White et al., 1989) y también hubo una reducción del 30% en el rendimiento del algodón (Khanh et al., 2006).
Plagas
A menudo se plantea la cuestión de que los cultivos de cobertura albergan plagas. Ha habido casos en los que las poblaciones de chinches apestosas u otras plagas se han acumulado en los cultivos de cobertura y posteriormente se han trasladado a otros campos para dañar los cultivos comerciales (Bugg, 1991). Otras publicaciones, como la de ATTRA Companion Planting & Botanical Pesticides: Concepts & Resources, muestra que el momento y la selección de los cultivos pueden ser muy eficaces para atraer a los depredadores de las plagas y también para repelerlas en algunos casos.
Aunque desempeñan un papel en la supresión de las malas hierbas, los cultivos de cobertura de leguminosas pueden, por el contrario, aumentar el rendimiento de los cultivos posteriores o complementarios. La acumulación de nitrógeno por parte de las legumbres para el cultivo posterior es el objetivo de los cultivos de cobertura, o al menos uno de los principales beneficios. El rendimiento y sus componentes deberían verse afectados de forma positiva, y el grado en que un determinado cultivo de cobertura afecta al rendimiento es una consideración a tener en cuenta. Se sabe que las leguminosas fijan el nitrógeno y que otros cultivos se benefician de ese nitrógeno de diversas maneras. Sin embargo, es importante recordar que cada legumbre fija una cantidad diferente de nitrógeno y lo libera a un ritmo diferente. Estas tasas dependen no sólo de la especie de cultivo de cobertura, sino también de la fase de desarrollo de los cultivos que se van a utilizar. Un estudio descubrió que, después de un año, la Mucuna deeringiana, también conocida como judía de terciopelo, rendía casi 4.500 libras por acre de materia seca, pero, después de tres años, debido a la falta de persistencia y a otros factores, sólo recuperaban 117 libras por acre. Por otro lado, el Aeschynomene histrix, a veces llamado jointvetch del puercoespín, rindió unas 850 libras por acre el primer año, y al cabo de tres años había acumulado unas increíbles 4.000 libras por acre de materia seca, lo que representa un aumento del triple con respecto a la segunda cubierta de este estudio. En dicho estudio se plantaron campos en barbecho con varias semillas de cultivos de cobertura y luego se midió su crecimiento mediante un cuadrante. Después del tercer año, araron lo que crecía en la parcela y cultivaron maíz. Encontraron diferencias no sólo en el rendimiento del maíz sino también en el número de granos en las mazorcas (Okpara et al., 2005).
Algunas plantas, aunque son tremendas generadoras de biomasa, no son apropiadas como cultivos de cobertura debido a la dificultad de controlar su propagación. El aeschynomene, al igual que el kudzu, se excluye de esta publicación únicamente por su condición de maleza nociva. Aquí se puede encontrar una lista de malezas nocivas en Estados Unidos.
Opciones de cultivos de cobertura subtropicales
Parientes del cacahuete (Arachis spp.)
El cacahuete perenne(A. glabrata) es originario de Sudamérica. Esta planta se diferencia de su primo más conocido , el A. hypogaea, en que se propaga con mayor frecuencia a partir de sus rizomas, en lugar de por semillas. Puede cruzarse con otras especies estrechamente relacionadas como A. paraguariensis y A. kretschmeri, dando lugar a triploides estériles que sólo forman rizomas cortos. Su naturaleza rastrera hace que el cacahuete perenne sea adecuado como cultivo forrajero y cobertura del suelo del sotobosque de las plantaciones de frutas y frutos secos tropicales. Sin competencia puede extenderse dos metros por año, pero se espera menos de una sexta parte de eso con la competencia de la hierba. Por lo tanto, el establecimiento del rodal es muy importante cuando se utiliza el cacahuete perenne. El establecimiento del rodal se inicia mediante la plantación de ramitas, de forma muy similar a la plantación de césped Bermuda, y se puede utilizar el mismo equipo (Rouse et al., 2001).
La A. glabrata es una legumbre de uso múltiple. Fija unas 150 libras de nitrógeno por acre y año. Es apetecible para el ganado y se ha demostrado que es beneficioso para el aumento de peso y/o la producción de leche de varias especies. Además de aportar nitratos a los árboles frutales y de frutos secos y de proporcionar proteínas al ganado, también puede cortarse y empacarse para obtener heno y venderse. En algunos casos, los cacahuetes perennes se utilizan con fines ornamentales debido a sus vistosas flores amarillas (Miavitz y Rouse, 2002).
Los cacahuetes perennes prefieren suelos arenosos y bien drenados, con un pH que oscila entre 4,5 y 8, y no toleran el encharcamiento. Por lo general, A. glabrata necesita de 1.000 a 2.000 mm de lluvia al año, pero puede sobrevivir con 750 mm. Una variedad, la Latitud 34, puede sobrevivir con 450 mm (18 pulgadas) al año (Muir et al., 2010).
Hay otro cacahuete perenne que se utiliza en Hawai, el A. pintoi, que parece ser la especie más utilizada fuera de los Estados Unidos continentales. La mayor parte de la literatura australiana se centra en la variedad Amarillo, que se utiliza en los huertos de ese país (Hensley et al., 1997). Las dos especies son bastante similares en su mayor parte, pero reaccionan de forma diferente en situaciones distintas, como la sequía y el frío. A. pintoi (cacahuete perenne con semillas) produce más semillas que A. glabrata (cacahuete perenne rizomatoso), pero ninguno de ellos produce mucho en comparación con A. hypogaea (Gosper y Murray, 2003).
Guisante (Cajanus cajan)
El gandul es una hierba trifoliada erguida que, si se le permite, puede convertirse en un pequeño árbol en algunas variedades. Se trata de una planta perenne débil que se suele utilizar como anual, pero que puede vivir de tres a cinco años, siendo la producción de semillas más productiva en los dos primeros años. En el subcontinente indio hay varios parientes silvestres del gandul, lo que apoya la idea de que fue domesticado en esa región hace unos 3.500 años. Los gandules son un cultivo alimentario muy conocido y consumido en todo el mundo tropical, y se están investigando sus propiedades antipalúdicas. Se han utilizado tradicionalmente con ese fin en Ghana (Merel et al., 2004; Duker-Eshun et al., 2004).
Los gandules toleran la sequía y son muy adaptables. Incluso rinden bien en suelos carentes de nutrientes. Se sabe que este cultivo produce una cosecha incluso después de que otros se hayan marchitado. Los gandules representan alrededor del 5% del total de la producción mundial de legumbres (Odeny, 2007).
Como cultivo de cobertura, se ha demostrado que aumentan el rendimiento del maíz en casi un 33% en los sistemas de producción togoleses, que tienen una media de temperaturas de alrededor de 90º durante todo el año (Sogbedji et al., 2006). Los gandules incorporan el fósforo del suelo de forma muy eficiente a partir de los ortofosfatos y pueden incluso extraer el fósforo de los suelos con aluminio. Su porte erguido se presta a ser utilizado como cortavientos en parcelas adyacentes. Por ejemplo, en un campo de 1 acre, el tercio central del campo puede segarse e incorporarse al suelo, dejando los bordes intactos. Esto permitirá que el exterior actúe como cortavientos o como una especie de cultivo nodriza para el centro. Más tarde, los lados pueden ser segados, incorporados y luego replantados con un cultivo comercial o más cultivos de cobertura (Valenzuela, 2011).
Los gandules son buenos fijadores de nitrógeno que aportan bastante de ese nitrato a los cultivos posteriores a través de sus residuos. La mayoría de las leguminosas fijan el nitrógeno, pero algunas lo transmiten a otros cultivos mejor que otras. Las leguminosas arbóreas como la Leucaena, la Calliandra y la Acacia sólo pueden, en algunas circunstancias, convertir menos del 5% de sus nitratos en formas mineralizadas que otras plantas puedan utilizar. Los gandules, en cambio, ponen a disposición del siguiente cultivo alrededor del 20% de su nitrógeno total. Sin embargo, estas cifras parecen depender del entorno, ya que en otras circunstancias, la Leucaena aportó entre el 12% y el 28% de sus nitratos a los cultivos posteriores (Palm, 1995).
Guisante de perdiz; Cassia de hoja redonda (Cassia/Chamaecrista spp.)
Como cubierta, la cassia es eficaz en la recuperación de zonas minadas en superficie debido a su excelente potencial pionero. Las zonas minadas tienen poca fertilidad, materia orgánica, macronutrientes y micronutrientes, y sobre todo flora y fauna del suelo y microorganismos.
La casia de hoja redonda es originaria de América. Se distribuye desde México y el Caribe en el norte hasta Argentina en el sur. La mayoría de las cassias son árboles pequeños, pero este tipo sólo alcanza un metro de altura. Hay un par de especies de Cassia que se prestan a ser utilizadas como cultivos de cobertura. La primera es C. rotundifolia, que tiene hojas más redondas y puede ser más postrada. La otra es la C. fasciculata o guisante de perdiz, que está en posición vertical. Esta última es originaria de Texas, el sureste de Estados Unidos y México; puede verse floreciendo en los pastos hasta las heladas. Es relativamente poco afectada por las enfermedades y sufre pocas plagas.
La raíz se utilizaba tradicionalmente en la medicina de los nativos americanos como estimulante y para aumentar la resistencia (Hamel y Chiltoskey, 1975).
El guisante de perdiz se adapta a las zonas en las que hay un drenaje adecuado, así como a la humedad. En otras palabras, aprecian los suelos arenosos. También se dan bien en los suelos arcillosos rojos agotados del sur de China. Estos suelos son bajos en macronutrientes, micronutrientes y oligoelementos, así como altos en aluminio, pero aun así la Cassia de hoja redonda es productiva (Hacker et al., 1997). Estos suelos arcillosos rojos son algo similares a los que se encuentran en todo el sur húmedo de Estados Unidos.
La casia no debe ser pastoreada por el ganado cuando se encuentra en las últimas etapas de crecimiento, es decir, después de la floración, debido a problemas de toxicidad. No se recomienda para los caballos.
Como cubierta, la cassia es eficaz en la recuperación de zonas minadas en superficie debido a su excelente potencial pionero. Las zonas minadas tienen poca fertilidad, materia orgánica, macronutrientes y micronutrientes, y sobre todo flora y fauna del suelo y microorganismos. La casia puede prosperar en estas condiciones e iniciar el proceso de recuperación (Gillman, 2014). Fija el nitrógeno en buenas cantidades, teniendo un rendimiento casi tan bueno como una aplicación de 100 libras por acre de N al fertilizar el maíz plantado en su residuo incorporado (Tanimu et al., 2007).
Centrosema (Centrosema spp.)
La Centrosema es una planta herbácea perenne de tallos delicados y preciosas flores papilionáceas de color lavanda de las que procede el nombre común: guisante de mariposa. Se trata de una enredadera que se enrosca en lugar de un zarcillo, lo que significa que todo el tallo gira alrededor del objeto que utiliza como soporte mientras crece. El fruto es una legumbre delgada y aplanada que se rompe cuando está completamente seca, emitiendo así sus semillas. Tiene raíces pivotantes y raíces fibrosas que penetran profundamente en el suelo, lo que le permite estabilizar taludes o riberas y recoger minerales del subsuelo (Heuzé y Tran, 2016).
Se han realizado pocos trabajos de mejora en Centrosema, y las variedades locales de diferentes regiones muestran una gama variable de adaptabilidad, por lo que existe el potencial de desarrollar cultivares de Centrosema específicos para cada región o clima.
La Centrosema pubescens ha sido estudiada por sus propiedades medicinales. Se ha utilizado entre el pueblo ibibio de Nigeria para las quemaduras, e investigaciones recientes han demostrado que tiene un uso potencial como agente de curación de heridas debido a sus fuertes efectos antimicrobianos y antifúngicos (Ekpo et al., 2011).
Varias especies se utilizan como cultivos de cobertura y forraje, como C . virginianum, que se distribuye desde Argentina hasta el sur de Estados Unidos. C. molle(C. pubescens) y C. brasilianum son muy similares a C. virginianum en apariencia y propiedades. El Centro soporta mejor la humedad y el anegamiento que muchos cultivos de cobertura de leguminosas, por lo que es adecuado para los fondos de los ríos y las llanuras de inundación.
El rendimiento de la Centrosema varía mucho de una región a otra. En Brasil, puede producir 40 toneladas de biomasa fresca por acre al año (FAO Ecocrop, 2007) o tres toneladas de materia seca, pero en Queensland, Australia, produjo 13 toneladas de materia seca por acre. Esto alude de nuevo a la falta de esfuerzos de mejora realizados en este cultivo y señala su potencial de adaptación (FAO, sin fecha b). Un estudio nigeriano demostró que Centrosema(brasilianum y pascuorum) sólo tenía un rendimiento mediocre entre los 13 cultivos de cobertura que probaron en el campo (Tian et al., 2000). Las precipitaciones fueron adecuadas, por lo que puede haber habido otras condiciones presentes que limitaron la producción porque sus parcelas de Centrosema sólo fijaron el 11% de las 135 libras por acre de nitrógeno que este cultivo ha fijado en otros lugares (Tian et al., 2000; FAO, sin fecha b). Más tarde, Tanimu y su grupo (2007) descubrieron que la Centrosema incorporada al suelo era una de las que más beneficios nutricionales aportaba al cultivo de maíz posterior, de entre varios cultivos de cobertura diferentes. Centrosema se inocula con inoculantes del grupo del caupí.
Como hay varias especies de Centrosema disponibles, hay que conocer sus necesidades específicas. Por ejemplo, C. brasilianum y C. pascuorum. Cuando se encuentra en las primeras etapas de crecimiento, C. brasilianum tiene una alta necesidad de agua, mientras que C. pascuorum tiene una necesidad menor. Sin embargo, en la etapa de madurez, las necesidades de agua de las dos especies se han nivelado (Salako y Tian, 2003).
Como muchas otras leguminosas, Centrosema se beneficia de la aplicación adicional de fósforo en situaciones de carencia. Una aplicación de 60 libras por acre produjo unas 300 libras más de semilla por acre que la parcela sin enmendar. La aplicación de fósforo también mejoró el peso de las semillas y duplicó la producción de materia seca y casi duplicó el contenido de proteína bruta del control no fertilizado (Omokanye, 2001).
Guisante mariposa (Clitoria ternatea)
La Clitoria está muy relacionada con la Centrosema: ambas son de la subtribu Clitorinae, y de hecho sus flores son muy similares, así como su hábito de crecimiento enroscado y con tallos delicados. La Centrosema es trifoliada, pero la Clitoria es pinnada, con cinco a siete delicados foliolos. Las vainas de las semillas de la Clitoria son mucho más grandes que las de su prima, pero también son relativamente planas y estrechas. Es una vid perenne que no tolera las heladas.
Aunque la Centrosema es originaria de América, la Clitoria es originaria de África. Existen varios sinónimos de Clitoria ternatea, como albiflora, bracteata, mearnsii, tanganicensis y zanzibarensis, pero la bibliografía se ha decantado principalmente por el primer término. Al igual que la Centrosema, ha habido poco desarrollo de cultivares, pero afortunadamente ya está ampliamente adaptada de forma natural (Staples, 1992).
En cuanto a los usos secundarios, la Clitoria se ha utilizado en la medicina tradicional ayurvédica durante muchos años (Mukherjee et al., 2008). En el sudeste asiático se utiliza (las flores) como colorante alimentario natural, especialmente para el arroz. Esta práctica aumenta el contenido fitoquímico del arroz y enriquece la dieta con antioxidantes (Yusof, 2015). Las flores también se pueden rebozar, como en la tempura. Otro uso de las flores es la elaboración de bebidas de color azul que cambian de color al añadir zumo de lima. Es una enredadera ornamental majestuosa que puede utilizarse como pantalla. Además de ser un buen cultivo de cobertura, también es un cultivo forrajero muy beneficioso para las cabras y es una excelente especie pionera para los terrenos alterados.
Debido a la naturaleza altamente ornamental de la Clitoria, las semillas están fácilmente disponibles, pero pueden no estar específicamente adaptadas para el uso de cultivos de cobertura o pueden no estar disponibles en las cantidades necesarias para las necesidades de los cultivos de cobertura. En este caso, la propagación será importante. La Clitoria se autopoliniza, como muchas leguminosas, y fácilmente establece cantidades prodigiosas de semillas viables de una sola planta.
Las raíces de la clitoria toleran las inundaciones de corta duración, pero no pueden sobrevivir con los “pies mojados” durante mucho tiempo. Aprecian las precipitaciones estivales a un ritmo de unas 18 pulgadas, y una precipitación media anual de unas 54 pulgadas. (Conway et al., 2001).
Dependiendo del entorno, la Clitoria puede producir hasta 15 toneladas de materia seca por acre cada año si se gestiona adecuadamente y se dan las condiciones ideales. En los lugares más secos, espere menos de seis toneladas por acre de producción total. En el transcurso de una temporada, se pueden producir unas 700 libras de semillas en un acre. Debido a la naturaleza indeterminada del cultivo, las flores y las vainas pueden estar en diferentes etapas de desarrollo en un momento dado, por lo que la cosecha no será uniforme (Reid y Sinclair, 1980).
Clitoria se beneficia de la inoculación de Rhizobium por el grupo de inoculantes del caupí. También puede, en un grado limitado, ser colonizado por inoculantes de soja (Oblisami, 1974).
Además del fósforo suplementario, Clitoria también responde bien al zinc adicional, pero responde mucho mejor al manganeso y al boro (Dayal et al., 2015).
Cascabel, Cascabel, Cáñamo de sol (Crotolaria juncea)
En los últimos años hemos visto un aumento de la popularidad del uso del cáñamo Sunn. Es un cultivo de cobertura de temporada cálida versátil y útil.
Beneficios del cáñamo solar en las explotaciones ecológicas subtropicales
Trabajo realizado en una tesis por Savannah Rugg
El cáñamo de sol (Crotalaria juncea) fue elegido como cultivo de cobertura para mi investigación de tesis en la multifuncionalidad de los cultivos de cobertura en el sur de Texas debido a su capacidad para soportar altas temperaturas y climas húmedos. El cultivo se realizó en dos fincas diferentes con distintos tipos de suelo y subclimas. La primera granja, Terra Preta farm en Edinburg, Texas, tuvo un gran índice de germinación en un suelo franco arenoso. Sin embargo, con la elevada presión de los conejos, el cultivo fue pastoreado y no produjo un buen rodal. Si los conejos u otros herbívoros son plagas en su explotación, puede considerar la posibilidad de utilizar una legumbre menos apetecible como cultivo de cobertura.
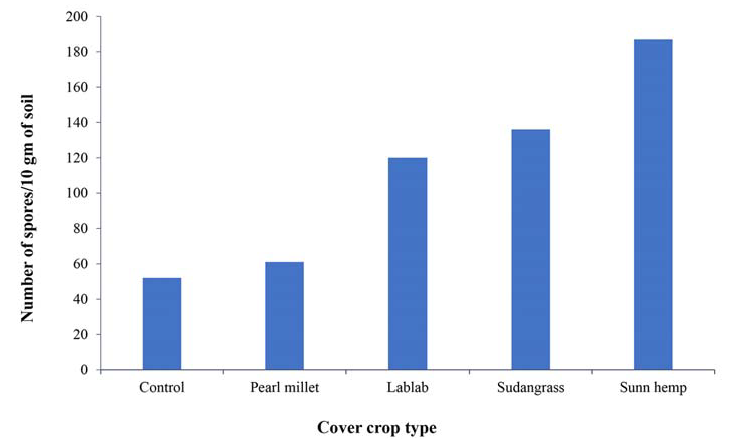
Figura 3.
Número de esporas de micorrizas por 10 gramos de suelo bajo cada cultivo de cobertura. Nuestros resultados indican que la densidad de las esporas de las micorrizas estaba influenciada por la identidad del cultivo de cobertura. El mayor número de esporas se encontró bajo el cáñamo Sunn, seguido de la hierba del Sudán y el lablab (Sotiet al., 2016).
Número de esporas de micorrizas por 10 gramos de suelo bajo cada cultivo de cobertura. Nuestros resultados indican que la densidad de las esporas de las micorrizas estaba influenciada por la identidad del cultivo de cobertura. El mayor número de esporas se encontró bajo el cáñamo Sunn, seguido de la hierba del Sudán y el lablab (Soti et al., 2016).
La segunda parcela, la granja Yahweh de Harlingen (Texas), tiene un suelo arcilloso y experimenta más precipitaciones que la granja de Edinburg. La fecha de siembra se retrasó debido a las fuertes lluvias de mayo y junio, por lo que el cultivo de cobertura no se sembró hasta el 2 de julio de 2015. El cáñamo Sunn se comportó bastante bien en esta granja y produjo 4540 libras por acre de biomasa seca. En cuanto a la supresión de las malas hierbas, hubo una relación entre el cultivo de cobertura y las malas hierbas de 4,58 libras: 1 libra (biomasa seca por acre), por lo que la parcela no estaba libre de malas hierbas, pero el cultivo de cobertura superó a la competencia de malas hierbas. Esto podría deberse a la fecha de plantación tardía, ya que un ensayo anterior plantado a principios de año tenía un rodal mucho más denso y menos presencia de malas hierbas en el campo. El cáñamo de sol se comportó muy bien al promover las esporas de mychorrizae en el suelo. En comparación con el control, que tenía 50 esporas/10 gramos de tierra, Sunn Hemp tenía 187 esporas/10 gramos de tierra.
El cáñamo al sol dio lugar a la mayor concentración de nitratos en el suelo. Sin embargo, al contrario de lo que esperábamos, el Lablab provocó un descenso del nitrato del suelo. Una posible explicación de este resultado podría ser la elevada densidad de malas hierbas en las parcelas de lablab en relación con los demás tratamientos. Del mismo modo, el cáñamo Sunn también superó a otros tratamientos en la conservación del fósforo en el suelo, lo que indica su potencial como cultivo de cobertura de temporada cálida para mejorar la salud del suelo en los agroecosistemas subtropicales.
Tabla 1. Cambio en el estado de los nutrientes del suelo después de cada cultivo de cobertura (en ppm).
Los números se calculan restando la concentración de nutrientes del suelo antes del cultivo de cobertura de la concentración de nutrientes después del cultivo de cobertura (Soti et al., 2016).
Mijo perla Lablab Cáñamo al sol Hierba de Sudán Controlar Boro 0.2 0.55 0.9 0.45 0.2 Calcio 1852 1406.5 1427 500 3360 Cobre 0.6 0.2 0.4 -0.1 -2.3 Hierro 0.1 0.1 0.15 0.15 0 Magnesio 24 28 35.5 13.5 27 Manganeso -1 -0.5 0.65 -2.45 -6.7 Nitrato 2 -3 7.5 0.5 2 OM% 0.45 0.87 1.46 1.08 -0.48 pH 0.1 0.05 0 0 0.1 Fósforo 9.9 19.2 19.3 15.35 6.8 Potasio 142 205.5 205.5 138.5 143 Azufre 0.4 -14.25 -18.65 -12.8 -32.9 Zinc 0.6 0.5 0.6 0.25 -5.3 En general, el cáñamo Sunn fue el que mejor funcionó para mejorar la biología y la química del suelo en la temporada de siembra de verano en el sur de Texas. Si un agricultor está tratando de mejorar la densidad de micorrizas, la materia orgánica del suelo y los nitratos en el perfil del suelo, entonces el cáñamo Sunn sería una gran opción para un cultivo de cobertura. Sin embargo, si la supresión de las malas hierbas es el principal servicio que un agricultor busca en un cultivo de cobertura, puede que quiera probar la hierba de Sudán o asegurar una fecha de siembra más temprana para proporcionar más cobertura de dosel. El cáñamo solar tiene el potencial de ser un gran cultivo de cobertura de verano en los climas cálidos y húmedos del sur de Texas.
Garrapata, trébol de garrapata, piojos de la garrapata o piojos de la mendicidad (Desmodium spp.)
Esta leguminosa de vainas segmentadas utiliza pelos en forma de gancho para esparcir sus semillas encerradas y se conoce comúnmente como “trébol garrapata”. Al igual que el trébol, es una legumbre fijadora de nitrógeno, pero su hábito de crecimiento se asemeja más a una versión menos agresiva del kudzu. A diferencia del kudzu, el Desmodium no es una maleza nociva; de hecho, ninguno de los cultivos de cobertura de esta publicación es considerado maleza nociva por el USDA (USDA-NRCS, 2016).
El desmodium es originario de Sudamérica, pero ahora se ha naturalizado en muchos trópicos húmedos y de montaña de todo el mundo. Existen varias formas, entre ellas D . uncinatum (hojas plateadas) y D. intortum (hojas verdes). La D. uncinatum tolera mejor las inundaciones, los niveles freáticos altos y el pH más bajo que la forma de hoja verde. Ninguno de ellos es adecuado para los suelos arcillosos, ya que no soportan el encharcamiento. A la inversa, tampoco les gusta que esté demasiado seco. Durante los periodos de sequía, las vides entrarán en letargo, pero la propia planta persistirá durante un tiempo. Es evidente que un suelo bien drenado y una pluviometría o un riego adecuados son importantes para el Desmodium. Necesita suelos no salinos de pH 5 o superior (Hacker, 1992).
El trébol garrapata está ampliamente introducido; el género puede encontrarse en todo Estados Unidos, pero estas dos formas más tropicales no son tan comunes. Tienen algunas propiedades interesantes que las hacen deseables. En primer lugar, como cultivo forrajero, Desmodium intortum contiene taninos condensados. Los taninos condensados en exceso pueden hacer que los forrajes sean poco apetecibles para el ganado, pero en las cantidades adecuadas pueden ayudar a controlar el Haemonchus contortus en rumiantes como las cabras y las ovejas (Debela et al., 2012). En segundo lugar, Pickett et al. (2014) documentaron el uso de Desmodium en sistemas de cultivo de empuje y arrastre en el África subsahariana, también conocidos como sistemas de estímulo-disuasión, para reducir los daños en el maíz por lepidópteros barrenadores del tallo. Luego, Midega et al. (2014) demostraron que era económicamente viable hacerlo, no sólo en función del rendimiento del maíz, sino también de las cosechas potenciales del Desmodium intercalado u otras legumbres.
Lablab (Lablab purpureus)
Esta vid es originaria de África y se utiliza allí y en toda Asia desde hace muchos años. Es un género monotípico, lo que significa que sólo hay una especie dentro del género: Lablab purpureus, antes conocido como Dolichos lablab. Aunque sólo existe una especie, hay varias subespecies, variedades locales y cultivares debido a la adaptación local. Las vides pueden ser anuales o perennes de corta duración. Las hojas pueden comerse crudas o cocidas, pero las semillas deben cocinarse para destruir los glucósidos cianogénicos que pueden provocar vómitos, dificultad respiratoria, debilitamiento y convulsiones. Además de alimento, las judías jacinto son un eficaz atrayente para la fauna (ciervos) y un cultivo ornamental.
Como cultivo de cobertura, es bastante eficaz para asfixiar las malas hierbas y fijar el nitrógeno. Debido a su lento crecimiento inicial, las malas hierbas deben ser controladas durante su establecimiento. Una vez que comienza a crecer activamente, es un competidor agresivo y desplazará y dará sombra a las malas hierbas que vayan surgiendo (Sheahan, 2012). Una vez cortada y secada, la biomasa de Lablab contiene alrededor de 50 libras de nitratos por acre.
Algunos de los tipos trepadores pueden llegar a medir 25 pies de largo, pero sin apoyo en condiciones de campo, suelen alcanzar 40 pulgadas de altura más o menos. Aunque es un cultivo de cobertura y una fuente de alimento para humanos y animales, también puede ser muy ornamental. Sus flores son bastante vistosas, y luego les siguen las vainas de semillas de color púrpura. Las semillas son blancas o negras según la variedad, y algunos tipos silvestres tienen semillas moteadas. Las semillas tienen una característica peculiar: un hilio blanco alargado. Las vistosas flores atraen a los polinizadores, pero la vid está sujeta al mismo complemento de insectos que atacan a las judías.
El Lablab prefiere suelos ácidos con un rango de pH de 4,5 a 7 aproximadamente. No tolera muy bien las inundaciones y puede ser bastante tolerante a la sequía después de su establecimiento. Requiere un mínimo de unas 30 pulgadas de lluvia al año (Valenzuela y Smith, 2002). Además del Rhizobium, el Lablab también inocula con éxito el grupo Vigna del Bradyrhizobium. Se ha demostrado que Bradyrhizobium mejora los componentes del rendimiento de los frijoles jacinto, como el peso seco de los brotes y el rendimiento general, sin influir significativamente en el tamaño de la vaina, lo que significa que el aumento del rendimiento fue de un mayor número de vainas producidas por planta (Ibrahim et al., 2011).
La judía jacinto también alivia la compactación del suelo más rápidamente que las hierbas. Las raíces del Lablab aumentan el espacio poroso interconectado en suelos compactados tres veces más rápido que las hierbas como el sorgo. El Lablab también redujo el tamaño de los pedos del suelo, aunque el sorgo y el trigo no lo hicieron. Esta investigación sugiere que, dado que el Lablab aumentó la porosidad y redujo el tamaño de los pedos en el suelo compactado, también aumentaría la tasa de infiltración y reduciría la escorrentía, lo que también serviría para acelerar el proceso de reparación de la compactación (Pillai y McGarry, 1999).
El Lablab se beneficia de las asociaciones de raíces con micorrizas vesículo-arbusculares, especialmente Glomus mosseae. En estudios de campo, G. mosseae aumentó la materia seca, la nodulación rizobiana y la absorción de fósforo. La nodulación adicional condujo a una mayor captación de nitratos (Mahdi y Atabani, 1992).
El Lablab requiere mayores cantidades de unidades de calor que cultivos como el trébol o los guisantes de invierno. Debe cultivarse en zonas adecuadas para su producción, o sufrirá una depresión del rendimiento. Un estudio de Carolina del Norte demostró que no era un lugar ideal para la producción de Lablab. En primer lugar, no pudieron conseguir una buena nodulación, lo que contribuyó a un bajo rendimiento; esto subraya la importancia de la inoculación. A continuación, el control de malas hierbas superó al Lablab, y de hecho las malas hierbas dentro de la parcela de Lablab alcanzaron más de la mitad de la biomasa del propio Lablab, lo que subraya la necesidad de desherbar a principios de la temporada. Por último, es posible que en Carolina del Norte no haya suficiente calor o intensidad de rayos UV para que el Lablab prospere. En este estudio también se incluyó la Mucuna, y su rendimiento fue tan pobre como el del Lablab (Creamer y Baldwin, 2000).
Tabla 2. Algunas características agronómicas de algunos cultivos de cobertura adecuados para zonas cálidas y húmedas.
| especie | zona | pH del suelo | tipo de suelo | tasa de siembra lb/acre | nitrógeno fijado lb por acre | Toneladas de DM por acre | reducción de la erosión | supresión de malezas | ¿proporciona heno? | ¿proporciona un producto secundario? | ¿pastoreo? | compactación del suelo | tamaño de las semillas | salinidad | beneficiarios | micorrizas | porcentaje de germinación esperado%. | tiempo de germinación días | inoculante | etapa de uso del agua |
| ARACHIS glabrata | 7-11 | 4.5-8.0 | franco arenoso | trasplante | 100 | 2.85 | alto | bajo | sí | sí, ornamental | sí | libera | 0,1 cm | MT | polinizadores | positivo | trasplante | N/A | grupo cowpea | establecimiento:alto |
| CAJANUS cajan | 9 | 5.0-7.0 | cualquier | 5 | 90 | 2.2 | alto | bajo | sí | sí, la comida | luz | alivia | 0,6cm | MT | parasitoides | positivo | 91 | 14-21 | grupo cowpea | maduro: medio |
| CASSIA spp | 3-11 | 5.0-7.5 | cualquier | 5 | 100 | 1.87 | alto | alto | no | sí, medicinal | no | no hay pruebas | 0,3cm | S | polinizadores | positivo | 48 | 25 | grupo cowpea | maduro: medio |
| CENTROSEMA molle/pubescens | 7-9 | 4.9-5.5 | franco arenoso | 6 | 250 | 1.64 | medio | alto | sí | sí, medicinal | sí | alivia | 0,5cm | S | polinizadores | positivo | 60 | 10 | grupo cowpea | intermedio:medio |
| CLITORIA ternatea | 7-10 | 6.6-7.5 | cualquier | 12 | 281 | 3.07 | bajo | bajo | sí | sí, medicinal, ornamental | sí | alivia | 0,6cm | MS | polinizadores | positivo | 80 | 14-21 | soja o caupí | maduro: medio |
| CROTALARIA juncea | 9b-11b | 5.0-7.5 | arena-marga | 50 | 278 | 2.5 | medio | alto | no | sí, fibra, reduce los nematodos | no | alivia | 0,6cm | S | hábitat | positivo | 85 | 4-10 | grupo cowpea | temprano: alto |
| DESMODIUM uncinatum | 13 | 5.5-7.0 | cualquier | 12 | 98 | 2.08 | alto | alto | sí | sí, medicinal | luz | alivia | 0,3cm | S | polinizadores | positivo | 65 | 4-10 | grupo cowpea | maduro: medio |
| LABLAB purpureus | 8-11 | 4.5-6.5 | cualquier | 40 | 220 | 8.9 | alto | alto | sí | sí, alimentos, ornamentales | sí | alivia | 1cm | MS | polinizadores | positivo | 75 | 7-14 | bradyrhizobium | temprano: alto |
| MUCUNA pruriens | 9b-11 | 5.5-6.5 | sandy | 30 | 150 | 4.9 | alto | alto | sí | sí, medicinal | sí | alivia | 1,5cm | MS | nematodos | positivo | 70 | 3-14 | grupo cowpea | temprano: alto |
| PHASEOLUS coccineus | 7-11 | 6.6-7.5 | cualquier | 150 | 125 | 6.99 | alto | bajo | no | sí, alimentos, ornamentales | sí | alivia | 2cm | MS | polinizadores | positivo | 94 | 7 | Grupo de judías | intermedio: medio |
| STYLOSANTHES guayanensis | 8-11 | 4.0-8.3 | franco arenoso | 3 | 100 | 15.61 | medio | alto | sí | no | sí | alivia | 0,2cm | S | repele las termitas | positivo | 90 | 2-5 | grupo cowpea | intermedio: medio |
| VIGNA radiata | 7-11 | 6.2-7.2 | franco arenoso | 15 | 80 | 1.65 | alto | bajo | sí | sí, la comida | sí | alivia | 0,3mm | S | parasitoides | positivo | 95 | 5-7 | grupo cowpea | temprano: alto |
Salinidad: MT = moderadamente tolerante; MS = moderadamente susceptible; S=susceptible
Descargo de responsabilidad: esta información se basa en las investigaciones disponibles en ese momento. Cada campo y granja es diferente, por lo que los resultados variarán y deberán adaptarse a su situación particular.
El peso de las semillas varía según el proveedor.
Alubia de terciopelo, cowage, cowitch, alubia lacuna, alubia de Lyon (Mucuna spp.)
La Mucuna es muy versátil y puede crecer en suelos con un pH de 5 a 8, siempre que estén bien drenados. Estas grandes vides requieren entre 38 y 42 pulgadas de lluvia cada año. La Mucuna es capaz de fijar hasta 150 libras de nitrógeno por acre.
La mucuna es una legumbre subtropical que produce cantidades prodigiosas de follaje y es probablemente originaria del sur de Asia. Allí se consume mucho después de una minuciosa preparación. Allí también se utiliza en preparados medicinales. Se ha descubierto que contiene L-Dopa, que se utiliza para la terapia de la enfermedad de Parkinson. También se le ha llamado afrodisíaco, se usa para las picaduras de escorpión y se utiliza para tratar la artritis. También se ha utilizado como antidiabético, antihelmíntico y antibiótico, y contiene compuestos antioxidantes, antivirales, anticancerígenos y antiinflamatorios. Aunque tienen propiedades medicinales, las judías de terciopelo son más conocidas por provocar un fuerte picor (Lampariello et al., 2012). Las vainas y algunas partes de las flores están cubiertas de pelos urticantes que se utilizan en el polvo para el picor. En la mayor parte del mundo, el frijol terciopelo no es invasivo, pero en el sur de Florida la planta puede ser un poco agresiva. Sin embargo, no se considera nocivo. Es esencial que el cultivo se gestione adecuadamente para evitar la aparición de malas hierbas.
La mucuna es perenne pero se trata como anual en el sur de Estados Unidos. Las plantas son trifoliadas y trepadoras, y se parecen al kudzu pero con vainas y semillas mucho más grandes.
La Mucuna es muy versátil y puede crecer en suelos con un pH de 5 a 8, siempre que estén bien drenados. Estas grandes vides requieren entre 38 y 42 pulgadas de lluvia cada año. La Mucuna es capaz de fijar hasta 150 libras de nitrógeno por acre.
M. pruriens se presenta en dos subespecies y cuatro variedades. La variedad de consecuencia es M. pruriens var. utilis, que no provoca picores intensos. Las alubias terciopelo se utilizaron en su día ampliamente en el sur de Estados Unidos, pero fueron suplantadas por la soja.
En un experimento realizado en Togo, se demostró que la siembra continua de maíz reduce el nitrato disponible en el suelo en casi un 60%. Al incorporar la judía terciopelo a la rotación del maíz, se produjo una ganancia neta del 39% respecto al control. El frijol terciopelo no sólo sustituyó lo que el cultivo de maíz eliminó, sino que también añadió más nitrato del que se utilizó, evitando así la necesidad de aportes adicionales de nitrato (Sogbedji et al., 2006). También se comprobó que M. pruriens aumentó el rendimiento del maíz más que el fertilizante a base de urea en algunos años. Los investigadores dejaron que la judía aterciopelada creciera durante 20 semanas y luego cortaron las cepas para utilizarlas como mantillo para el posterior cultivo de maíz. Su trabajo aisló el nitrógeno recuperado de la posterior cosecha de maíz. Se demostró que, aunque se recuperó más nitrógeno de la parcela tratada con urea, la parcela con mantillo de Mucuna rindió más, lo que indica que el aumento del rendimiento no podía atribuirse únicamente al contenido de nitrato, sino que debía proceder de otros factores que el mantillo aportaba al suelo (Tian et al., 2000). Esto refuerza la noción de que la agricultura orgánica o regenerativa es un sistema sinérgico más que un conjunto de sus componentes individuales. Para reforzar este concepto, un estudio llevado a cabo en Benín demostró que el maíz intercalado con la judía de terciopelo tenía más actividad biológica en el suelo que el maíz monocultivado, tanto con fertilización NPK como sin ella. Esta actividad añadida de la microfauna del suelo condujo a una reducción del número de nematodos fitófagos obligados como Meloidogyne y Nacobbus, que son plagas de muchas especies de cultivos (Blanchart et al., 2006; Caamal-Maldonado et al., 2001).
M. bracteata es útil en las plantaciones de caucho de la India y Malasia. Es posible que se adapte a su uso en las plantaciones de cítricos del Valle del Río Grande o de Florida y a los campos de papaya.
Judía escarlata o judía multiflora (Phaseolus coccineus)
Los corredores escarlata son un poco anómalos con respecto al resto de los cultivos de cobertura de esta publicación. Los otros son cultivos de cobertura probados según la investigación, pero los corredores escarlatas tienen el potencial de ser cultivos de cobertura según el uso indígena.
La judía roja está estrechamente relacionada con la judía común, Phaseolus vulgaris. Son similares en algunos aspectos, pero difieren principalmente en dos áreas. La primera es el tamaño: ¡las judías rojas son ENORMES! El crecimiento vegetativo es mayor, más vigoroso y robusto, al igual que las semillas y las flores. La otra diferencia es que los corredores escarlata tienen una raíz perenne con almidón. Algunos grupos indígenas consumen estas raíces, así como los granos y las vainas jóvenes que se consumen más comúnmente (Cairns, 2015). Sin embargo, algunos informan de que el tubérculo es venenoso y no debe comerse (Ashworth, 2002). Es probable que existan variedades autóctonas que hayan sido seleccionadas para obtener tubérculos comestibles, o que los indígenas empleen diversas técnicas para eliminar las toxinas. Utilizan el mismo inoculante que las alubias comunes, a diferencia de la mayoría de los que aparecen en esta publicación, que utilizan inoculante de caupí.
Las especies de Phaseolus se desarrollaron en las Américas y fueron parte integral de la vida de muchos pueblos nativos. El ciclo vital de los corredores escarlata coincide exactamente con el del maíz; esto se hizo por diseño. Su hábito de crecimiento es adecuado y su época de cosecha es correcta para ser intercalada con el maíz. Esto se realiza en algunas partes de América Central y del Sur a alturas superiores a los 1.500 pies. Los estolones escarlata necesitan un poco más de apoyo que los frijoles comunes, por lo que cuando se utilizan estolones escarlata con maíz, la densidad de siembra de los frijoles se reduce a una proporción de 1 frijol por cada 10 maíces en lugar de 1 por cada uno como con los frijoles comunes (Cairns, 2015). No todas las plantas de gran altura pueden utilizarse como compañeras de las judías escarlatas, ya que Hamburdă et al. (2014) descubrieron que había un cierto retraso en el rendimiento (-70% respecto a la media) cuando se plantaban con patacas, pero cuando se plantaban con girasoles, las judías escarlatas rendían un 20% más que la media en Rumanía. En otro experimento, el corredor escarlata cultivado con maíz en Wisconsin mejoró significativamente el rendimiento en materia seca, casi duplicándolo respecto al maíz monocultivado (Armstrong et al., 2008). El grupo rumano llegó a la conclusión de que las judías de mesa eran económicas para intercalarlas tanto con el maíz como con el girasol y que las judías creaban un microclima ideal para su intercultivo (Hamburdă et al., 2015).
Dado que los corredores escarlata están más adaptados a las zonas altas de los trópicos (al igual que el café), es importante buscar variedades adaptadas localmente. En América Central y México, existen variedades locales de escarola que han sido seleccionadas para muchas situaciones, incluyendo zonas de clima cálido y seco (Delgado-Salinas, 1988). Algunas variedades dependen de la duración del día y pueden no dar frutos el primer año. Así que, si no hay variedades específicamente adaptadas a su zona y decide seleccionar su propia adaptación, la paciencia es la clave.
Normalmente, cuando se plantan las judías, los cotiledones salen de la tierra y se abren para captar la luz. Los frijoles escarlata no hacen esto en absoluto. Sus cotiledones permanecen bajo la superficie del suelo, protegidos de cualquier daño. Otra diferencia entre los estolones escarlata y otras judías es que se enroscan en el sentido de las agujas del reloj alrededor de postes, espalderas u otros soportes (Ashworth, 2002).
Los corredores escarlata son un poco anómalos con respecto al resto de los cultivos de cobertura de esta publicación. Los otros son cultivos de cobertura probados según la investigación, pero los corredores escarlatas tienen el potencial de ser cultivos de cobertura según el uso indígena.
Stylosanthes (Stylosanthes spp.)
El Stylosanthes es un subarbusto perenne con muchas ramas, originario de América del Sur. Tiene hojas trifoliadas y flores amarillas. A diferencia de muchas leguminosas, sus semillas vienen en una sola vaina y se rompen con facilidad, lo que dificulta la cosecha mecánica. Es bastante tolerante a la sequía una vez establecida, necesitando generalmente entre 700 y 900 mm de lluvia al año, pero muy susceptible a las inundaciones (Stace y Edye, 1984). Una regla general con Stylosanthes es que si las plantas pantanosas pueden vivir en su campo, entonces Stylo no puede. La Stylosanthes requiere suelos bien drenados que no sean propensos a la formación de costras, debido al pequeño tamaño de sus semillas. Puede tolerar suelos ácidos, pero prefiere los neutros.
La Stylosanthes ha tenido un uso medicinal limitado. Se utiliza sobre todo por sus propiedades antiinflamatorias para la artritis (Nageswaraiah et al., 2013), y las encías inflamadas (Rekha et al., 2014).
Hay algunas especies que se utilizan actualmente, como S. guianensis y S. hamata. Hay más de 40 especies de Stylosanthes, divididas en dos subgéneros: Styposanthes y Stylosanthes (Maass y Sawkins, 2004). El género está estrechamente relacionado con los cacahuetes, que también evolucionaron en la misma región. Las flores de Stylosanthes y de su “primo” Arachis se parecen mucho, y utilizan el mismo inoculante. Esta publicación se centra en S. guianensis.
Es imprescindible saber cómo los cultivos de cobertura pueden afectar a los cultivos posteriores. Si no hay literatura disponible, pruebe con algunas parcelas de prueba y verifique la compatibilidad.
Stylosanthes produce una cantidad limitada de materia seca de alta calidad por acre. Por lo general, rinde menos de cinco toneladas al año, pero puede aumentar considerablemente la carga ganadera de una determinada parcela y mejorar el aumento de peso del ganado entre 60 y 160 libras por cabeza, al año. Si no se desfolia repetidamente mediante la siega o el pastoreo, puede no persistir entre los rodales de hierba alta. Cuando se pastorea repetidamente, el Stylosanthes forma una roseta postrada y rastrera; sin embargo, es mejor segar o permitir el pastoreo mientras las plantas están todavía en una etapa suculenta de crecimiento. Una vez que las plantas se vuelven leñosas, la siega o el pastoreo excesivo pueden matarlas (Jingura et al., 2001). Además de ser un excelente alimento para el ganado vacuno, también es un alimento muy eficaz para el ganado porcino, lo que aumenta los beneficios de los productores al reducir el índice de conversión alimenticia (Keoboualapheth y Mikled, 2003).
Stylo está siendo investigado por sus propiedades alelopáticas. Se ha demostrado que reduce la biomasa de las malas hierbas en un 80% a razón de una tonelada de materia seca por acre. Esto condujo a un aumento del 40% en el rendimiento del arroz (Khanh et al., 2006), pero otro estudio demostró que Stylosanthes afecta negativamente a la germinación de las semillas de algodón (Brown y Davis, 1992). Es imprescindible saber cómo los cultivos de cobertura pueden afectar a los cultivos posteriores. Si no hay literatura disponible, pruebe con algunas parcelas de prueba y verifique la compatibilidad.
Judía verde (Vigna radiata)
Las judías mungo, también conocidas como gramo verde, son originarias de Irán (Tomooka et al., 2003) o del subcontinente indio (Lambrides y Godwin, 2006), según la referencia que se encuentre primero. Es probable que se haya extendido rápidamente a través del comercio o que haya tenido múltiples domesticaciones, como sugiere Fuller (2007).
Hay muchísimos cultivares y razas autóctonas de judías mungo. La base de datos GRIN del ARS de la UDSA cuenta con más de 4600 accesiones solamente, sin mencionar las accesiones del AVRDC y el número incalculable de frijoles mungo que han sido cultivados por diferentes familias en todo el mundo (USDA ARS GRIN, 2016; AVDRC, 2016). La mayoría de los representantes de este versátil cultivo se crían específicamente para la producción de legumbres (semillas de leguminosas secas utilizadas para la alimentación). Las judías mungo se consumen de una variedad de formas casi tan amplia como sus numerosas razas autóctonas, incluidas las germinadas. Sin embargo, algunas cepas han sido reconocidas por otro rasgo que es común en este Género: la prodigiosa enredadera. La mayoría de las veces, cuando pensamos en cultivos de cobertura de verano en el sur húmedo, nos vienen a la mente los guisantes de hierro y arcilla. Se trata de la Vigna unguicalata, una “prima” de la judía mungo, de la que se ha hablado mucho en la bibliografía disponible, por lo que no es necesario tratarla aquí. Una ventaja que tiene el mung sobre los guisantes de hierro y arcilla es el menor tamaño de sus semillas. Esto permite que las semillas germinen más rápido que los guisantes de hierro y arcilla, que es lo que los hace atractivos para su uso como brotes, pero los propósitos agronómicos prácticos de los tiempos de germinación más rápidos son menos tiempo en una etapa vulnerable, menos agua necesaria para germinar y una mejor cobertura del suelo para suprimir las malas hierbas.
Tal vez esta germinación más rápida explique por qué Butler et al. (2014) observaron una diferencia tan importante entre V. radiata y las otras leguminosas de estación cálida que cultivaron en sitios desde Oklahoma hasta Texas. Fue, con diferencia, la que mejor funcionó en dos de los tres lugares en los que se cultivó y ocupó el segundo lugar en el tercer lugar, por detrás de los guisantes de hierro y arcilla por sólo 160 libras por acre. La diferencia entre V. radiata y su competidor más cercano en los otros dos lugares era de casi 1.000 libras por acre.
El frijol mungo puede fijar hasta 250 libras por acre de nitrógeno cuando se inocula con el Rhizobium adecuado (Heuzé et al., 2015) del grupo de inoculantes del caupí.
Hay algunas otras especies de Vigna de semilla pequeña que también son dignas de mención en la producción de cultivos de cobertura, a saber, las judías adzuki y las judías de arroz, V. angularis y V. umbellata, respectivamente. Tienen muchos rasgos en común con las judías mungo.
Referencias
Armstrong, K.L., K.A. Albrecht, J.G. Lauer y H. Riday. 2008. Cultivo intercalado de maíz con judía Lablab, judía terciopelo y judía escarlata para forraje. Ciencia de los cultivos. Enero-febrero.
Ashworth, S. 2002. De semilla a semilla: Técnicas de conservación y cultivo de semillas para horticultores. Seed Savers Exchange, Decorah, IA.
AVRDC. 2016. Centro Mundial de la Verdura.
Bailey, G.E. 1915. Nitrificación del suelo mediante legumbres inoculadas. Publicaciones de la Universidad del Sur de California. Vol. 2, nº 1.
Bayer, C., L. Martin-Neto, J. Mielniczuk, C.N. Pillon y L. Sangoi. 2000. Cambios en las fracciones de materia orgánica del suelo bajo sistemas de cultivo subtropical sin labranza. Revista de la Soil Science Society of America. Vol. 65, nº 5. p. 1473-1478.
Blanchart, E., C. Villenave, A. Viallatoux, B. Barthes, C. Girardin, A. Azontonde y C. Feller. 2006. Efecto a largo plazo de un cultivo de cobertura de leguminosas (Mucuna pruriens var. utilis) sobre las comunidades de macrofauna y nematofauna del suelo, bajo cultivo de maíz, en el sur de Benín. Revista Europea de Biología del Suelo. En octubre. p. S136-S144.
Actividad de quitinasa en Stylosanthes guianensis protegida sistemáticamente contra Colletotrichum goeosporoides.
Brown, A.E., y R.D. Davis. 1992. Revista de Fitopatología. Vol. 136. p. 247-256.
Bugg, R. L. 1991. Cultivos de cobertura y control de artrópodos plaga de la agricultura. En: W.L. Hargrove (ed.) Cover Crops for Clean Water. Proc of an Int Conf Soil and Water Conservation Society, SWCS, Ankeny, IA. p. 157-163.
Butler, T.J., S.M. Interrante y J.L. Foster. 2014. Evaluación de la producción y el valor nutritivo de las leguminosas de temporada cálida en Oklahoma y Texas.Forage and Grazinglands. En enero. p. 1-6.
Caamal-Maldonado, J.A., J.J. Jiménez-Osornio, A. Torres-Barragán y A.L. Anaya. 2001. Utilización de especies alelopáticas de cobertura y acolchado de leguminosas para el control de las malas hierbas en los sistemas de cultivo. Revista de Agronomía. Vol. 93. p. 27-36.
Cairns, M. 2015. Cultivo itinerante y cambio ambiental: Agricultura de los pueblos indígenas y conservación de los bosques. Routledge, Nueva York, NY.
Conway, M.J., K. McCosker, V. Osten, S. Coaker y B.C. Pengelly. 2001. Guisante mariposa – Una historia de éxito de las leguminosas en las tierras de cultivo de Queensland Central. En: B. Rowe, N. Mendham, y D. Donaghy, (eds.). Actas de la 10ª Conferencia Australiana de Agronomía, Hobart. Revista de praderas tropicales. Vol. 39, nº 4. p. 124-127.
Creamer, N.G., y K.R. Baldwin. 2000. Una evaluación de los cultivos de cobertura de verano para su uso en sistemas de producción de hortalizas en Carolina del Norte. HortScience. En julio. p. 600-603.
Dayal, D., A. Kumar, M.L. Swami, D. Machiwal, S. Manglassery, S.C. Vyas y H. Kunpara. 2015. Prácticas de manejo para mejorar la producción de forraje del guisante mariposa (Clitoria ternatea). Capítulo 18: p. 215-224. Devi Dayal, Deepesh Machiwal, Shamsudheen Mangalassery y R.S. Tripathi (eds.) En: Improving Productivity of Drylands by Sustainable Resource Utilization & Management, Edición: 2016. New India Publishing Agency, Nueva Delhi, India.
Debela, E., A. Tolera, L.O. Eik. y R. Salte. 2012. Taninos condensados de Sesbania sesban y Desmodium intortum como medio de control de Haemonchus contortus en cabras. Sanidad y producción animal tropical. Diciembre. p. 1939-1944.
Delgado-Salinas, A. 1988. Variación, taxonomía, domesticación y potencialidades de germoplasma en Phaseolus coccineus. p. 441-466. En: P. Gepts (ed.).Genetic Resources of Phaseolus Beans. Kluwer Academic, Dordrecht, Holanda.
Duker-Eshun, G., J.W. Jaroszewski, W.A. Asomaning, F. Oppong-Boachie y S.B. Christensen. 2004. Componentes antiplasmódicos de Cajanus cajan. Investigación sobre fitoterapia. En febrero. p. 128-130.
Ekpo, M., H. Mbagwu, C. Jackson y M. Eno. 2011. Actividades antimicrobianas y de curación de heridas de Centrosema pubescens (Leguminosae). Revista de Farmacia y Ciencias Clínicas. Abril-junio. p. 1-6.
FAO. Sin fecha a. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma, Italia. Aplicación de sistemas de fijación de nitrógeno en la gestión del suelo. Boletín de suelos de la FAO 49.
Perfiles de especies de pastizales. Sin fecha b. Centrosema pubescens Benth.Organización de las Naciones Unidas para la Agricultura y la Alimentación.
FAO Ecocrop. 2007. Centrosema pubescens. Ecocultivo.
Fox, J.E., J. Gulledge, E. Engelhaupt, M.E. Burow y J.A. McLachlan. 2007. Los plaguicidas reducen la eficiencia simbiótica de los rizobios fijadores de nitrógeno y las plantas huésped. Actas de la Academia Nacional de Ciencias. El 12 de junio. p. 10282-10287.
Fuller, D.Q. 2007. Patrones contrastados en la domesticación de cultivos y en las tasas de domesticación: conocimientos arqueobotánicos recientes del Viejo Mundo. Anales de Botánica. Vol. 100, No.5. p. 903-924.
Gage, D.J. 2004. Infección e invasión de las raíces por rizobios simbióticos fijadores de nitrógeno durante la nodulación de leguminosas templadas. Revisiones de Microbiología y Biología Molecular. En junio. p. 280-300.
Gillman, J. 2014. Hierbas nativas de temporada cálida en terrenos mineros recuperados: guía de gestión para el propietario. Hoja informativa sobre la gestión del suelo. Publicación 2082 de la División del Servicio Geológico de Missouri.
Gosper, H., y G. Murray. 2003. Cultivos de cobertura para huertos subtropicales. Agfact H6.3.10. Programa de horticultura de NSW Agriculture.
Hacker, J.B. 1992. Plant Resources of South-East Asia No. 4. Forrajes. Desmodium intortum (Miller) Urban. p. 114-115. En: L. ‘t Mannetje y R.M. Jones, (eds.). Pudoc Scientific Publishers, Wageningen, Países Bajos.
Hacker, J.B., C. Liu, L. Chungchu y X. Minggang. 1997. Oportunidades para seleccionar líneas mejoradas de Chamaecrista rotundifolia para el sur de China. En: J.M. Scott, D.A. MacLeod, Minggang Xu y A.J. Casanova, (eds.). Forrajes para la zona de suelos rojos de China. Documento de trabajo de ACIAR nº 55.
Hamburdă, S.B., N. Munteanu, V. Stoleru, G. Butnariu, G.C. Teliban y L.D. Popa. 2014. Resultados experimentales en el cultivo de judías (Phaseolus coccineus L.) en sistema de cultivo intercalado. Lucrări Stiintifice Vol. 57, nº 1: Seria Horticultură
Hamburdă, S. B., N. Munteanu y G.C. Teliban. 2015. Cultivo intercalado – un sistema exitoso para el cultivo de frijol (Phaseolus coccineus L.). Boletín UASVM Horticultura. Vol. 72, nº 1. p. 81-86.
Hamel, P.B., y M. Chiltoskey. 1975. Las plantas cherokee y sus usos: Una historia de 400 años. Herald Publishing Company, Sylva, NC.
Hensley, David, Julie Yogi y Joseph DeFrank. 1997. Cubierta vegetal de cacahuete perenne. Colegio de Agricultura Tropical y Recursos Humanos, Universidad de Hawai en Manoa, Honolulu, HI.
Heuzé, V., y G. Tran. 2016. Centro (Centrosema molle). Feedipedia, un programa del INRA, el CIRAD, la AFZ y la FAO.
Heuzé, V., G. Tran, D. Bastianelli y F. Lebas. 2015. Alubia mungo (Vigna radiata). Feedipedia, un programa del INRA, el CIRAD, la AFZ y la FAO.
Hue, N.V., G.R. Craddock y F. Adams. 1985. Efecto de los ácidos orgánicos en la toxicidad del aluminio en los subsuelos. SSSAJ. Vol. 50, nº 1. p. 28-34.
Hue, N.V., S. Vega y J.A. Silva. 1999. Toxicidad del manganeso en un oxisol hawaiano afectado por el pH del suelo y las enmiendas orgánicas. SSSAJ. Vol. 65, nº 1. p. 153-160.
Ibrahim, K.A., E.A.E. ElSheikh, A.M. El Naim, y E.A. Mohammed. 2011. Efectos de la inoculación de Bradyrhizobium sobre el rendimiento y los componentes del rendimiento de la judía jacinto (Dolichos lablab L.). Revista australiana de ciencias básicas y aplicadas. Vol. 5, nº 6. p. 303-310.
Jeuffroy, M.H., C. Duthion, J.M. Meynard y A. Pigeaire. 1990. Efecto de un corto período de altas temperaturas diurnas durante la floración sobre el número de semillas por vaina de guisante (Pisum sativum L). Agronomía, EDP Sciences. Vol. 10, nº 2. p. 139-145.
Jingura, R.M., S. Sibanda y H. Hamudikuwanda. 2001. Pastizales tropicales. Vol. 35. p. 168-174.
Keoboualapheth, C., y C. Mikled. 2003. Desempeño de crecimiento de cerdos indígenas alimentados con Stylosanthes guianensis CIAT 184 como reemplazo del salvado de arroz. Investigación ganadera para el desarrollo rural. Vol. 15, nº 9.
Khanh, T.D., N.H. Hong, D.Q. Nhan, S.L. Kim, I.M. Chung y T.D. Xuan. 2006. Actividad herbicida de Stylosanthes guianensis y sus componentes fitotóxicos. Revista de Agronomía y Ciencia de los Cultivos Vol. 192. p. 427-433.
Kirschbaum, M.U.F. 1995. La dependencia de la temperatura en la descomposición de la materia orgánica del suelo, y el efecto del calentamiento global en el almacenamiento de C orgánico del suelo. Biología y bioquímica del suelo. En junio. p. 753-760.
Lambrides, C.J., y I.D. Godwin. 2006. Mapeo del genoma y mejoramiento molecular en plantas, 3. Mungbean. p. 69-90. En: K. Chittarajan. Springer, Nueva York, NY.
Lampariello, L.R., A. Cortelazzo, R. Guerranti, C. Sticozzi y G. Valacchi. 2012. La judía mágica de Mucuna pruriens.The Journal of Traditional and Complimentary Medicine. Vol. 2, nº 4. p. 331-339.
Maass, B., y M. Sawkins. 2004. Historia, relaciones y diversidad entre las especies de Stylosanthes de importancia comercial. En: Chakraborty S. High-Yielding Anthracnose-Resistant Stylosanthes for Agricultural Systems (PDF). Centro Australiano de Investigación Agrícola Internacional (ACIAR). p. 9-26.
Mahdi, A.A., y I.M.A. Atabani, 1992. Respuesta de la soja inoculada con Braydrhizobium y de la judía lablab a la inoculación con micorrizas arbusculares vesiculares. Agricultura experimental. Vol. 28. p. 243-249.
Merel, H., A. Akoègninou y J. van der Maesen. 2004. Plantas medicinales utilizadas para tratar la malaria en el sur de Benín. Botánica económica. En diciembre. p. S239-S252.
Miavitz, E., y R. Rouse. 2002. Cacahuetes perennes rizados en el paisaje urbano. Actas de la Sociedad de Horticultura del Estado de Florida. Vol. 115. p. 136-138.
Midega, C.A.O., D. Salifu, T.J. Bruce, J. Pittchar, J.A. Pickett y Z.R. Khan. 2014.Efectos acumulativos y beneficios económicos del cultivo intercalado de maíz con leguminosas alimentarias sobre la infestación de Striga hermonthica. Investigación sobre cultivos de campo. Vol. 155. p. 144-152.
Mukherjee, P.K., V. Kumar, N.S. Kumar y M. Heinrich. 2008. La medicina ayurvédica Clitoria ternatea: del uso tradicional a la evaluación científica. Revista de Etnofarmacología. Vol. 120. p. 291-301.
Muir, J.P. 2012. Perspectivas de los sistemas de leguminosas forrajeras para las praderas de hierba alta y mixta de las Grandes Llanuras del Sur de Texas y Oklahoma. Ciencia de los cultivos. Vol. 53. Septiembre-octubre. p. 1971-1979.
Muir, J.P., T.J. Butler, W.R. Ocumpaugh y C.E. Simpson. 2010. ‘Latitude 34’, un cacahuete perenne para climas frescos y secos. Revista de Registros Vegetales. Vol. 4. p. 106-108.
Nageswaraiah, B., N. Dorababu, G.R. Battu, S. Satyanarayana, Y. Nagendra y B. Mohan. 2013. Actividad antiinflamatoria del extracto metanólico de las hojas de Stylosanthes fruticosa (Retz.). Revista Internacional de Ciencias Químicas y Farmacéuticas. En septiembre. Vol. 4, nº 3. p. 123-126.
Oblisami, G. 1974. Estudios sobre el Rhizobium y el patrón de nodulación en una leguminosa forrajera, Clitoria ternatea. Actas de la Academia Nacional de Ciencias, India Sección B: Ciencias Biológicas. Vol. 40. p. 618-623.
Odeny, D.A. 2007. El potencial del gandul (Cajanus cajan (L.) Millsp.) en África. Natural Resources Forum. Vol. 31. p. 297-305.
O’Gara, F. 2005. Evaluación de la cassia de Wynn (Chamaecrista rotundifolia) como pasto y cultivo de heno para la zona de Douglas Daly en el Territorio del Norte. Boletín técnico nº 316. En junio.
Okpara, D.A., J.E.G. Ikeorgu y J.C. Njoku. 2005. Potencial de los cultivos de cobertura para la sustitución del barbecho corto en sistemas de producción de maíz de bajos insumos en los trópicos húmedos. Agroecosistemas tropicales y subtropicales. Vol. 5. p. 109-116.
Omokanye, A.T. 2001. Producción de semillas, residuo de hierba y contenido de proteína bruta de Centro (Centrosema pubescens) en el año de establecimiento en Shika, Nigeria Tropicultura. Vol. 19, nº 4. p. 176-179.
Palm, C.A. 1995. Contribución de los árboles agroforestales a las necesidades de nutrientes de las plantas intercaladas. Sistemas agroforestales. Vol. 30. p. 105-124.
Pickett J., C.M. Woodcock, C.A.O. Midega y Z.R. Khan. 2014. “Sistemas de cultivo push-pull”. Opinión actual en biotecnología. Vol. 26C. p. 125-132.
Pillai. U.P., y D. McGarry. 1999. Reparación de la estructura de un vertisol compactado con ciclos húmedos-secos y cultivos. Revista de la Soil Science Society of America. En diciembre. p. 201-210.
Rekha, D., A. Panneerselvam y N. Thajuddin. 2014. Estudios sobre plantas medicinales de A.V.V.M. Sri Pushpam College Campus Thanjavur district of Tamil nadu, Southern India. Revista Mundial de Investigación Farmacéutica. Vol. 3, nº 5. p. 785-820.
Reid, R., y D.F. Sinclair. 1980. Evaluación de una colección de Clitoria ternatea para la producción de forraje y grano. Comunicación sobre recursos genéticos. Vol. 1. p. 1-8.
Rouse, R.E., R.M. Muchovej y J.J. Mullahey. 2001. Guía para utilizar el cacahuete perenne como cultivo de cobertura en los cítricos. Hoja informativa HS-805 del Servicio de Extensión Cooperativa de Florida.
Salako, F.K., y G. Tian. 2003. Agotamiento del agua del suelo bajo diversos cultivos de cobertura de leguminosas en la sabana derivada de África Occidental. Agricultura, Ecosistemas y Medio Ambiente. Vol. 100. p. 173-180.
Sheahan, C.M. 2012. Guía de plantas de Lablab (Lablab purpureus). USDA-Servicio de Conservación de Recursos Naturales, Centro de Materiales Vegetales de Cape May. Cape May, NJ.
Sogbedji, J., H.M. van Es y K.L. Agbeko. 2006. Estrategias de cultivo de cobertura y gestión de nutrientes para la producción de maíz en África Occidental. Revista de Agronomía. Vol. 98, No.4. En junio. p. 883-889.
Solomon, T. y M. Flores. 1994. Cultivo intercalado de maíz y frijol chinapopo (Phaseolus coccineus). CIDDICO Tegucigalpa MDC, Honduras.
Soti, P.G., S. Rugg y A. Racelis. 2016. Potencial de los cultivos de cobertura para promover la diversidad de micorrizas y la calidad del suelo en las explotaciones ecológicas. Revista de Ciencias Agrícolas. Vol. 8, nº 8. p. 42-47.
Stace, H.M., y L.A. Edye . (editores). 1984. La biología y la agronomía de Stylosanthes. Academic Press, Sydney, Australia.
Staples, I.P. 1992.Clitoria ternatea L. En: L. ‘t Mannetje y R.M. Jones (eds.). Plant Resources of South-East Asia No. 4. Forrajes. Pudoc Scientific Publishers, Wageningen, Países Bajos. p. 94-96.
Tanimu, J., E.N.O. Iwuafor, A.C. Odunze y G. Tian. 2007. Efecto de la incorporación de cultivos de cobertura con leguminosas sobre el rendimiento y los componentes del rendimiento del maíz. Revista Mundial de Ciencias Agrícolas. Vol. 3, nº 2. p. 243-249.
Tian, G., G.O. Kolawole, B.T. Kang y G. Kirchof. 2000. Índices de sustitución de fertilizantes nitrogenados de los cultivos de cobertura de leguminosas en la sabana derivada de África Occidental. Planta y suelo. Vol. 224. p. 287-296.
Tomooka, N., D.A. Vaughan, H. Moss, N. Mixted. 2003.La Vigna asiática: recursos genéticos del género Vigna subgénero Ceratotropis. Kluwer, Nueva York, Nueva York.
USDA ARS GRIN. 2016. Sistema Nacional de Germoplasma Vegetal. ESTADOS UNIDOS.
USDA-NRCS. 2016. Plantas introducidas, invasoras y nocivas.
Valenzuela, H. 2011. Hanai’Ai / El proveedor de alimentos. Los gandules: un cultivo polivalente para Hawai. Marzo-abril-mayo. p. 1-8.
Valenzuela, H., y J. Smith. 2002. Lablab. Agricultura sostenible Cultivos de abono verde. SA GM-7. CTAHR, Manoa, Hawaii.
Vieira, F.C.B., C. Bayer, J.A. Zanatta, J. Mielniczuk y J. Six. 2009. La acumulación de materia orgánica en un aleudult subtropical bajo rotaciones basadas en cultivos de cobertura de leguminosas. Revista de la Soil Science Society of America. Septiembre-octubre. p. 1699-1706.
Wang, K-H. 2012. Los cultivos de cobertura como plantas insectarias para potenciar los organismos beneficiosos por encima y por debajo del suelo. Hanai’Ai/El proveedor de alimentos. Marzo-abril-mayo. p. 1-7.
White, R.H., A.D. Worsham y U. Blum. 1989. Potencial alelopático de restos de legumbres y extractos acuosos. La ciencia de las malas hierbas. Septiembre de 1989. p. 674-679.
Yusof, N.A.B.A. 2015. Investigación sobre el colorante azul natural de Clitoria ternatea Fabacaeae (bunga telang): Los efectos de los estabilizadores en los extractos. Ingeniería química y de recursos naturales, Universidad de Malasia, Pahang.
Más recursos
Vídeos
Opciones de cultivos de cobertura para zonas cálidas y húmedas
Imitando a la naturaleza: La historia de los cultivos de cobertura de un agricultor
Gestión de los cultivos de cobertura en el sureste
Recursos en línea
Cultivos de cobertura y abonos verdes para Hawái
Programa de Agricultura Sostenible y Ecológica, Facultad de Agricultura Tropical y Recursos Humanos de la Universidad de Hawai
Cultivos de cobertura para el sureste
Programa de materiales vegetales del USDA-NRCS de Georgia
Apéndice 1: Grupos de inoculantes
i. Grupo de la alfalfa
Nombre común Nombre científico
Alfalfa Medicago sativa
Trébol de botón M. orbicularis
Trébol de California M. denticulata
Trébol manchado M. arabica
Médico negro M. lupulina
Caracolillo M. scutellata
Trébol tuberoso M. tuberculata
Trébol pequeño M. minima
Trébol de Tifton M. rigidula
Alfalfa amarilla M. falcata
Trébol dulce blanco Melilotus alba
Trébol dulce Huban M. alba annua
Trébol dulce amarillo M. officinalis
Trébol amargo M. indica
Alholva Trigonella foenumgraceum
ii. Grupo Clover
Trébol de Alsike Trifolium hybridum
Trébol carmesí T. incarnatum
Trébol de lúpulo T. agrarium
Trébol de lúpulo pequeño T. dubium
Trébol de lúpulo grande T. procumbens
Trébol de pies de conejo T. arvense
Trébol rojo T. pratense
Trébol blanco T. repens
Trébol ladino T. repens (giganteum)
Subclover T. subterraneum
Trébol de fresa T. fragiferum
Trébol de Berseem T. alexandrinum
Trébol en racimo T. glomeratum
Trébol en zigzag T. mediano
Trébol de bola T. nigrescens
Trébol persa T. resupinatum
Trébol de Carolina T. carolinianum
Trébol rosado T. hirtum
Trébol de búfalo T. reflexum
Trébol húngaro T. pannonicum
Trébol de mar T. wormskjoldii
Trébol lapón T. lappaceum
Trébol de flor grande T. michelianum
Trébol de hulla T. fucatum
iii. Grupo de guisantes y arvejas
Guisante de campo Pisum arvercse
Guisante de jardín P. sativum
Guisante de invierno australiano P. sativum (var arvense)
Veza común Vicia sativa
Veta peluda o de invierno V. villosa
Haba o haba V. faba
Veta de hoja estrecha V. angustiffolia
Veta púrpura V. atropurpurea
Arveja Monantha V. articulata
Guisante dulce Lathyrus odoratus
Guisante de agua L. hirsutus
Guisante de Tánger L. tingitanus
Guisante plano L. sylvestris
Lenteja Lens culinaris (esculenta)
iv. Grupo de los caupíes
Guisante de vaca Vigna sinensis
Judía espárrago V. sesquipedalis
Lespedeza común Lespedeza striata
Lespedeza coreana L. stipulacea
Sericea lespedeza L. cuneata
Trébol de arbusto delgado L. virginica
Crotalaria rayada Crotalaria mucronata
Crotalaria de sol (Sunnhemp) C. juncea
Crotalaria alada C. sagittalis
Hierba de la Florida Desmodium tortuosum
Trébol de la garrapata D. illinoense
Trébol de la India D. canescens
Kudzu Pueraria thunbergiana
Trébol de Alyce Alysicarpus vaginalis
Erythrina indica
Guisante de mesa Cajanus cajan (indicus)
Guar (judía en racimo) Cyamopsis tetragonoloba
Judía de caballo Canavalia ensiformis
Cacahuete (maní) Arachis hypogaea
Judía de terciopelo Mucuna deeringianum
Judía adzuki P. angularis
Judía mate P. aconitifolius
Frijol mungo P. aureus
Frijol Tepari P. acutifolius var latifolius
Acacia Acacia linifolia
Cuerno de canguro A. armata
Añil silvestre Baptisia tinctoria
Añil peludo Indigofera hirsuta
Guisante perdiz Chamaecrista fasciculata
v. Grupo Bean
Alubia de jardín, alubia roja Alubia blanca, alubia pinta Phaseolus vulgaris
Alubia de Lima Phaseolus lunatus (macrocarpus)
Judía escarlata P. coccineus (multiflorus)
vi. Grupo Lupino
Altramuz azul Lupinus angustifolius
Altramuz amarillo L. luteus
Altramuz blanco L. albus
Altramuz de Washington L. polyphyllus
Reloj de sol L. perennis
La campanilla de Texas L. subcarnosus
Serradella Ornithopus sativus
vii. Grupo de la soja
Todas las variedades de soja Glycine max (Soja max)
viii. Cepas únicas
Nombre común Nombre científico
Trébol de pies de pájaro Lotus corniculatus
Trébol grande L. uliginosus
Dalia cola de zorro Dalea alopecuroides
Langosta negra Robinia pseudoacacia
Frijol silvestre de arrastre Strophostyles helvola
Sesbania de cáñamo Sesbania exaltata
Trébol de Kura Trifolium ambiguum
Trébol Onobrychis vulgaris (sativus)
Veta de la corona Coronilla varia
Arbusto de guisante siberiano Caragana arborescens
Garbanzos Cicer arietinum
Planta de plomo Amorpha canescens
Madreselva francesa Hedysarum coronarium
Adaptado de Application of Nitrogen-Fixing Systems in Soil Management (FAO, sin fecha).
Opciones de cultivos de cobertura para zonas cálidas y húmedas
Por Justin Duncan, especialista en agricultura de NCAT
Publicado en abril de 2017
©NCAT
IP535
Esta publicación es producida por el Centro Nacional de Tecnología Apropiada a través del programa de Agricultura Sostenible de ATTRA, en virtud de un acuerdo de cooperación con el Desarrollo Rural del USDA. Esta publicación también ha sido posible en parte gracias a la financiación del Instituto Nacional de Alimentación y Agricultura del Departamento de Agricultura de los Estados Unidos, con el número de concesión 2013-51106-20970. ATTRA.NCAT.ORG.
Recursos relacionados
Publicaciones:
- Visión general de los cultivos de cobertura y los abonos verdes
- Estudio de caso sobre el cultivo sin labranza, Granja Miller: Restauración de tierras de pastoreo con cultivos de cobertura
- Estudio de caso sobre el no laboreo, granja Richter: Cócteles de cultivos de cobertura en un sistema basado en el forraje
Vídeos: